医疗器械设计是医学与工程学的紧密交叉领域,其核心要素直接决定产品的临床价值与安全性。根据FDA统计,2018-2023年间因设计缺陷导致的召回事件中,68%源于核心要素把控不足。索果小编基于ISO 13485质量体系,结合前沿技术发展趋势,系统解析医疗器械设计的五大核心要素及实施规范。
一、安全优先的风险控制体系
1. 生物相容性保障
材料安全性:直接接触材料需通过ISO 10993系列认证(细胞存活率>80%),植入物表面粗糙度Ra≤0.8μm(ASTM F2791)
化学物质控制:可浸出物含量符合USP<87>标准,邻苯二甲酸酯迁移量<0.1μg/cm²
灭菌耐受设计:耐受134℃高压蒸汽灭菌200次循环(ISO 17665),材料热变形温度>150℃
2. 物理安全防护
机械风险防控:锐角倒圆半径≥3mm(IEC 60601-1),动态部件设置双保险锁止(失效概率<10⁻⁶)
电气安全保障:漏电流<10μA(BF型设备),除颤防护能力>5kV(IEC 60601-2-4)
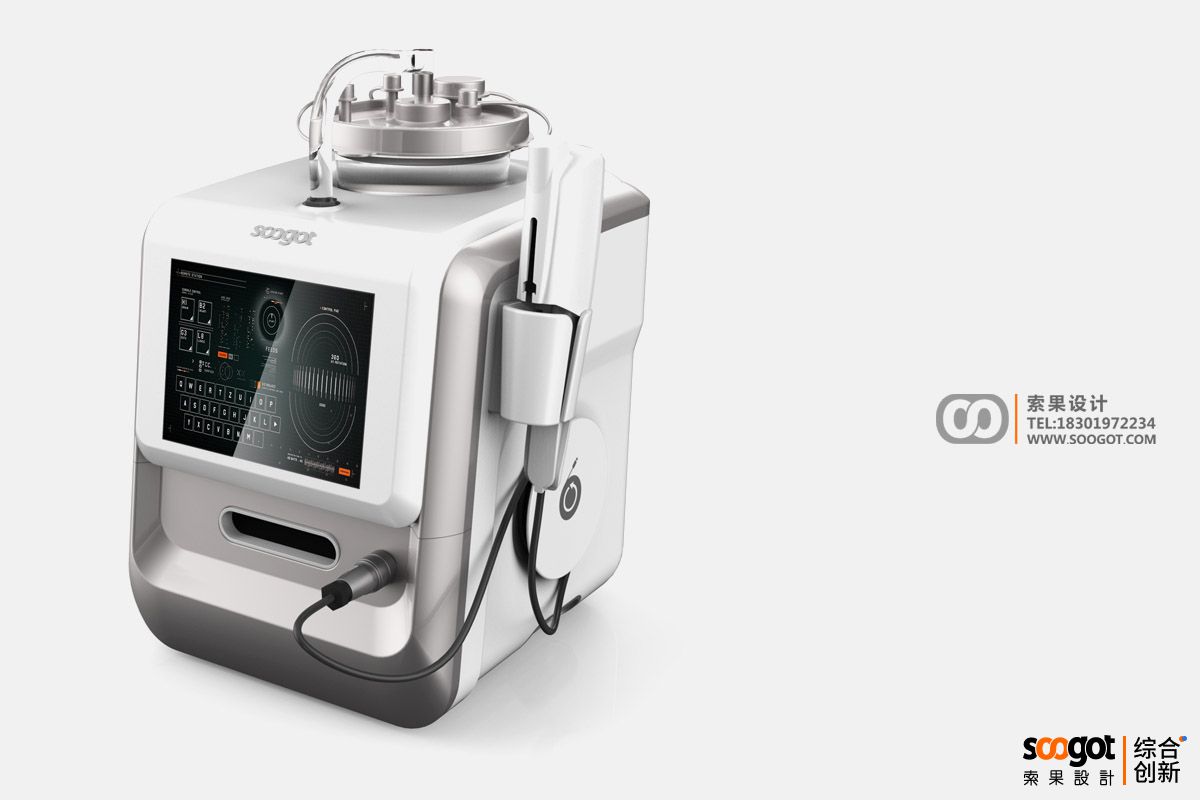
乳房旋切治疗仪产品设计
二、人因工程驱动的交互设计
1. 操作逻辑优化
三秒原则:高频功能触发时间≤3秒(如除颤仪充电),关键操作路径≤3步(Hick-Hyman定律)
防错机制:药物输注泵采用非对称接口(错误连接率<0.1%),旋钮设置触觉定位(每档扭矩变化0.05N·m)
多模态反馈:视觉(DICOM标准色域)、听觉(警报声压级55-85dB)、触觉(频率20-500Hz可调)
2. 环境适应性
极端工况验证:通过MIL-STD-810G振动测试(5-500Hz/3.5Grms),温湿度范围-40℃至70℃/95%RH(IEC 60068-2-30)
抗干扰设计:MRI兼容设备磁化率<3×10⁻⁶(钛合金),射频屏蔽效能>60dB
三、精准可靠的功能实现
1. 性能精度控制
设备类型 | 精度要求 | 测试标准 |
微创手术机器人 | 定位误差≤0.1mm | ISO 1101 |
血糖监测仪 | 误差±0.2mmol/L | ISO 15197 |
影像设备 | 空间分辨率≥20LP/cm | IEC 61223-3-5 |
2. 稳定性保障
加速老化验证:依据ASTM F1980模拟5年使用,性能衰减<10%
故障率控制:关键设备MTBF>10万小时(如西门子CT机架)
乳房旋切治疗仪产品设计
四、全生命周期合规管理
1. 全球法规适配
认证体系矩阵:
FDA 510(k):实质等效性证明(平均12个月)
欧盟MDR:临床评价报告+技术文档(18-24个月)
中国NMPA:人因工程研究+型检报告(16-20个月)
2. 风险管理闭环
FMEA实施:量化评估200+潜在失效模式,关键风险控制至ALARP水平
数字孪生验证:在虚拟环境中完成10万次操作模拟(覆盖98%使用场景)
五、可持续技术融合
1. 绿色材料革命
生物基材料:30%再生PEEK应用(碳足迹降40%),PLA降解周期≤24个月(ISO 14855)
轻量化设计:拓扑优化(Altair OptiStruct)减重30%保持强度(如联影CT机架)
2. 智能技术赋能
AI辅助诊断:肺结节检测灵敏度>99%(联影uAI平台)
自感知系统:植入式设备集成MEMS传感器(血糖监测精度±0.3mmol/L)
数字孪生运维:故障预测准确率>85%(西门子Teamplay系统)
技术演进与未来展望
医疗器械设计正经历三重变革:
1.材料突破:可降解镁合金支架(WE43)实现18个月精准降解,石墨烯电极使神经信号分辨率达0.1mV
2.制造革命:电子束熔融(EBM)3D打印将材料利用率提至98%,纳米涂层延长器械寿命3倍
3.智能融合:
脑机接口延迟压缩至20ms(BrainGate系统)
量子传感器实现单分子检测(灵敏度提升1000倍)
数字孪生使开发周期缩短60%
乳房旋切治疗仪产品设计
未来医疗器械设计需在安全底线(遵循ISO/TR 24971)、临床价值(QFD需求转化)、技术伦理(IEEE 7000标准)的三角框架中持续创新。通过医工交叉创新平台建设,推动高端医疗装备国产化率从2023年的45%提升至2030年的85%,最终实现“精准医疗,普惠民康”的核心使命。
索果设计:「长期服务:上海微创、美敦力、凯利泰、思路迪、昊海生物等。十年专注医疗实验室仪器的设计、落地和创新,设计覆盖产品开发全产业链:设计分析、外观设计、结构设计、ui界面设计、样机制作、小批量生产、模具开发、大批量生产等
上一篇:医疗器械设计的核心要素与实施路径
下一篇:医疗器械设计的科学原则与工程实践







 扫一扫添加微信
扫一扫添加微信